KATA PENGANTAR
Puji syukur kami panjatkan kehadirat Tuhan yang Maha Esa, yang atas
rahmat-Nya maka kami dapat menyelesaikan penyusunan makalah yang
berjudul “Minyak Bumi”. Penulisan makalah adalah merupakan salah satu
tugas dan persyaratan untuk menyelesaikan tugas mata pelajaran Kimia
Semester II di SMA N 1 Kuta Utara.Adapun di dalam makalah ini kami membahas tentang :
- Apa itu Minyak Bumi,
- Proses terbentuknya Minyak Bumi,
- Komposisi Minyak Bumi,
- Pengolahan Minyak Bumi,
- Produk Hasil Pengolahan, dan
- Akibat pembakaran bahan bakar fosil.
Akhirnya kami berharap semoga makalah ini membantu teman-teman mengetahui secara garis besar tentang Minyak Bumi. Terimakasih kami ucapkan atas waktunya untuk membaca makalah kami.
Dalung, 8 Februari 2013
Penyusun
DAFTAR ISI
Kata Pengantar ……………………………………………………….. i
Daftar Isi ……………………………………………………….. ii
BAB I Pendahuluan ………………………………. 1
1.1 Latar Belakang ………………………………. 1
1.2 Tujuan Penulisan ………………………………. 2
1.1 Latar Belakang ………………………………. 1
1.2 Tujuan Penulisan ………………………………. 2
BAB II Pembahasan ………………………………. 3
2.1 Minyak Bumi ………………………………. 3
2.2 Pembentukan Minyak Bumi ………………………. 4
2.3 Komposisi Minyak Bumi ………………………. 4
2.4 Pengolahan Minyak Bumi ………………………. 6
2.5 Produk Hasil Pengolahan ………………………. 7
2.6 Akibat Pembakaran Bahan Bakar Fosil ………. 13
2.1 Minyak Bumi ………………………………. 3
2.2 Pembentukan Minyak Bumi ………………………. 4
2.3 Komposisi Minyak Bumi ………………………. 4
2.4 Pengolahan Minyak Bumi ………………………. 6
2.5 Produk Hasil Pengolahan ………………………. 7
2.6 Akibat Pembakaran Bahan Bakar Fosil ………. 13
BAB III Penutup ………………………………………. 16
3.1 Kesimpulan ………………………………………. 16
3.2 Saran ………………………………………. 16
3.1 Kesimpulan ………………………………………. 16
3.2 Saran ………………………………………. 16
Daftar Pustaka ………………………………………………………. 17
BAB I
PENDAHULUAN
1.1 Latar BelakangSumber energi yang banyak digunakan untuk memasak, kendaraan bermotor dan industri berasal dari minyak bumi, gas alam, dan batubara. Ketiga jenis bahan bakar tersebut berasal dari pelapukan sisa-sisa organisme sehingga disebut bahan bakar fosil. Minyak bumi dan gas alam berasal dari jasad renik, tumbuhan dan hewan yang mati.
Sisa-sisa organisme itu mengendap di dasar bumi kemudian ditutupi lumpur. Lumpur tersebut lambat laun berubah menjadi batuan karena pengaruh tekanan lapisan di atasnya. Sementara itu dengan meningkatnya tekanan dan suhu, bakteri anaerob menguraikan sisa-sisa jasad renik itu menjadi minyak dan gas. Selain bahan bakar, minyak dan gas bumi merupakan bahan industri yang penting. Bahan-bahan atau produk yang dibuat dari minyak dan gas bumi ini disebut petrokimia. Baru-baru ini puluhan ribu jenis bahan petrokimia tersebut dapat digolongkan ke dalam plastik, serat sintetik, karet sintetik, pestisida, detergen, pelarut, pupuk, dan berbagai jenis obat.
Minyak bumi dan gas alam merupakan senyawa hidrokarbon. Rantai karbon yang menyusun minyak bumi dan gas alam memiliki jenis yang beragam dan tentunya dengan sifat dan karakteristik masing-masing. Sifat dan karakteristik dasar minyak bumi inilah yang menentukan perlakuan selanjutnya bagi minyak bumi itu sendiri pada pengolahannya. Hal ini juga akan mempengaruhi produk yang dihasilkan dari pengolahan minyak tersebut.
Pengetahuan tentang minyak bumi dan gas alam sangat penting untuk kita ketahui, mengingat minyak bumi dan gas alam adalah suatu sumber eneri yang tidak dapat diperbaharui, sedangkan penggunaan sumber energi ini dalam kehidupan kita sehari-hari cakupannya sangat luas dan cukup memegang peranan penting atau menguasai hajat hidup orang banyak. Sebagai contoh minyak bumi dan gas alam digunakan sebagai sumber energi yang banyak digunakan untuk memasak, kendaraan bermotor, dan industri, kedua bahan bakar tersebut berasal dari pelapukan sisa-sisa organisme sehingga disebut bahan bakar fosil.
Oleh karen itu sebagai generasi penerus bangsa, kita juga harus memikirkan bahan bakar alternatif apa yang dapat digunakan untuk menggantikan bahan bakar fosil ini, jika suatu saat nanti bahan bakar ini habis.
1.2 Tujuan Penulisan
Adapun tujuan penulisan dari makalah ini adalah:
a) Dapat mengetahui dan mendalami pengetahuan penyusun terkait minyak bumi.
b) Dapat mengetahui hasil pengolahan dari minyak bumi.
c) Dapat mengetahui manfaat serta kegunaan minyak bumi bagi kehidupan manusia.
d) Dapat mengetahui dampak yang ditimbulkan dari pembakaran minyak bumi yang tidak sempurna.
BAB II
PEMBAHASAN
2.1 Minyak BumiMinyak Bumi merupakan campuran dari berbagai macam hidrokarbon, jenis molekul yang paling sering ditemukan adalah alkana (baik yang rantai lurus maupun bercabang), sikloalkana, hidrokarbon aromatik, atau senyawa kompleks seperti aspaltena. Setiap minyak Bumi mempunyai keunikan molekulnya masing-masing, yang diketahui dari bentuk fisik dan ciri-ciri kimia, warna, dan viskositas.
Alkana, juga disebut dengan parafin, adalah hidrokarbon tersaturasi dengan rantai lurus atau bercabang yang molekulnya hanya mengandung unsur karbon dan hidrogen dengan rumus umum CnH2n+2. Pada umumnya minyak Bumi mengandung 5 sampai 40 atom karbon per molekulnya, meskipun molekul dengan jumlah karbon lebih sedikit/lebih banyak juga mungkin ada di dalam campuran tersebut.
Alkana dari pentana (C5H12) sampai oktana (C8H18) akan disuling menjadi bensin, sedangkan alkana jenis nonana (C9H20) sampai heksadekana (C16H34) akan disuling menjadi diesel, kerosene dan bahan bakar jet). Alkana dengan atom karbon 16 atau lebih akan disuling menjadi oli/pelumas. Alkana dengan jumlah atom karbon lebih besar lagi, misalnya parafin wax mempunyai 25 atom karbon, dan aspal mempunyai atom karbon lebih dari 35. Alkana dengan jumlah atom karbon 1 sampai 4 akan berbentuk gas dalam suhu ruangan, dan dijual sebagai elpiji (LPG). Di musim dingin, butana (C4H10), digunakan sebagai bahan campuran pada bensin, karena tekanan uap butana yang tinggi akan membantu mesin menyala pada musim dingin. Penggunaan alkana yang lain adalah sebagai pemantik rokok. Di beberapa negara, propana (C3H8) dapat dicairkan dibawah tekanan sedang, dan digunakan masyarakat sebagai bahan bakar transportasi maupun memasak.
Sikloalkana, juga dikenal dengan nama naptena, adalah hidrokarbon tersaturasi yang mempunyai satu atau lebih ikatan rangkap pada karbonnya, dengan rumus umum CnH2n. Sikloalkana memiliki ciri-ciri yang mirip dengan alkana tapi memiliki titik didih yang lebih tinggi.
Hidrokarbon aromatik adalah hidrokarbon tidak tersaturasi yang memiliki satu atau lebih cincin planar karbon-6 yang disebut cincin benzena, dimana atom hidrogen akan berikatan dengan atom karbon dengan rumus umum CnHn. Hidrokarbon seperti ini jika dibakar maka akan menimbulkan asap hitam pekat. Beberapa bersifat karsinogenik.
Semua jenis molekul yang berbeda-beda di atas dipisahkan dengan distilasi fraksional di tempat pengilangan minyak untuk menghasilkan bensin, bahan bakar jet, kerosin, dan hidrokarbon lainnya. Contohnya adalah 2,2,4-Trimetilpentana (isooktana), dipakai sebagai campuran utama dalam bensin, mempunyai rumus kimia C8H18 dan bereaksi dengan oksigen secara eksotermik:
2 C8H18(l) + 25 O2(g) → 16 CO2(g) + 18 H2O(g) + 10.86 MJ/mol (oktana)
Jumlah dari masing-masing molekul pada minyak Bumi dapat diteliti di laboratorium. Molekul-molekul ini biasanya akan diekstrak di sebuah pelarut, kemudian akan dipisahkan di kromatografi gas, dan kemudian bisa dideteksi dengan detektor yang cocok.
Pembakaran yang tidak sempurna dari minyak Bumi atau produk hasil olahannya akan menyebabkan produk sampingan yang beracun. Misalnya, terlalu sedikit oksigen yang bercampur maka akan menghasilkan karbon monoksida. Karena suhu dan tekanan yang tinggi di dalam mesin kendaraan, maka gas buang yang dihasilkan oleh mesin biasanya juga mengandung molekul nitrogen oksida yang dapat menimbulkan asbut.
2.2 Pembentukan Minyak Bumi
Proses terbentuknya minyak bumi dijelaskan berdasarkan dua teori, yaitu:
1) Teori Anorganik
Teori Anorganik dikemukakan oleh Berthelok (1866) yang menyatakan bahwa minyak bumi berasal dan reaksi kalsium karbida, CaC2 (dan reaksi antara batuan karbonat dan logam alkali) dan air menghasilkan asetilen yang dapat berubah menjadi minyak bumi pada temperatur dan tekanan tinggi.
CaCO3 + Alkali → CaC2 + HO → HC = CH → Minyak bumi
2) Teori OrganikTeori Organik dikemukakan oleh Engker yang menyatakan bahwa minyak bumi terbentuk dari proses pelapukan dan penguraian secara anaerob jasad renik (mikroorganisme) dari tumbuhan laut dalam batuan berpori.
2.3 Komposisi Minyak Bumi
Komposisi minyak bumi dikelompokkan ke dalam empat kelompok, yaitu:
a) Hidrokarbon Jenuh (alkana)
- Dikenal dengan alkana atau parafin
- Keberadaan rantai lurus sebagai komponen utama (terbanyak)
- Sedangkan rantai bercabang lebih sedikit
- Senyawa penyusun diantaranya:
- Metana CH4
- Etana CH3 – CH3
- Propana CH3 – CH2 – CH3
- Butana CH3 – (CH2)2 – CH3
- n-heptana CH3 – (CH2)5 – CH3
- iso oktana CH3 – C(CH3)2 – CH2 – CH – (CH3)2
- Dikenal dengan alkena
- Keberadaannya hanya sedikit
- Senyawa penyusunnya:
- Etena, CH2 = CH2
- Propena, CH2 = CH – CH3
- Butena, CH2 = CH – CH2 – CH3
- Dikenal dengan sikloalkana atau naftena
- Keberadaannya lebih sedikit dibanding alkana
- Senyawa penyusunnya :
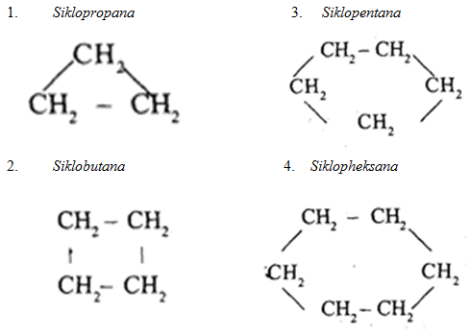
d) Hidrokarbon aromatik
- Dikenal sebagai seri aromatik
- Keberadaannya sebagai komponen yang kecil/sedikit
- Senyawa penyusunannya:
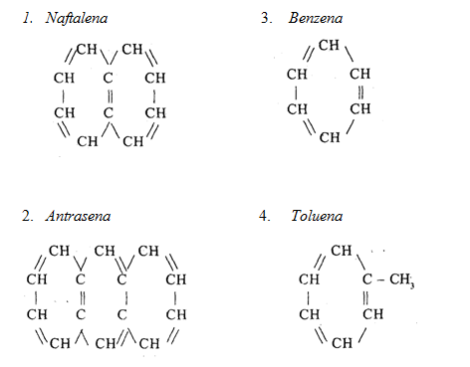
a) Senyawa Lain
- Keberadaannya sangat sedikit sekali
- Senyawa yang mungkin ada dalam minyak bumi adalah belerang, nitrogen, oksigen dan organo logam (kecil sekali)
2.4 Pengolahan Minyak Bumi
Minyak mentah yang peroleh dari pengeboran berupa cairan hitam kental yang pemanfaatannya harus diolah terlebih dahulu. Pengeboran minyak bumi di Indonesia, terdapat di pantai utara Jawa (Cepu, Wonokromo, Cirebon), Sumatra (Aceh, Riau), Kalimantan (Tarakan, Balikpapan) dan Irian (Papua). Pengolahan minyak bumi melalui dua tahapan, diantaranya:
a. Pengolahan pertama,Pada tahapan ini dilakukan “distilasi bertingkat memisahkan fraksi-fraksi minyak bumi berdasarkan titik didihnya. Komponen yang titik didihnya lebih tinggi akan tetap berupa cairan dan turun ke bawah. Sedangkan titik didihnya lebih rendah akan menguap dan naik ke bagian atas melalui sangkup-sangkup yang disebut sangkup gelembung.
- 1. Perengkahan (cracking)
- 2. Ekstrasi
- 3. Kristalisasi
- 4. Pembersihan dari kontaminasi

b. Ethyl Tertier Butil Eter (ETBE)
- ·Rumus molekul CH3 O C(CH3)3Tersier Amil Metil Eter (TAME)
- ·Rumus molekul CH3 O C(CH3)2 C2H5Metir Tersier Buthil Eter (MTBE)
- ·Rumus molekul CH3 O C(CH3)3
Bahan bakar gas terdiri dari LNG (Liquified Natural Gas) dan LPG (Liquified Petroleum Gas)
Bahan baker gas biasa digunakan untuk keperluan rumah tangga dan indusri.
Elpiji, LPG (liquified petroleum gas,harfiah: “gas minyak bumi yang dicairkan”), adalah campuran dari berbagai unsur hidrokarbon yang berasal darigas alam. Dengan menambah tekanan dan menurunkan suhunya, gas berubah menjadi cair. Komponennya didominasi propana C3H8 dan butana C4H10. Elpiji juga mengandung hidrokarbon ringan lain dalam jumlah kecil, misalnya etana C2H6 dan pentana C5H12.
Dalam kondisi atmosfer, elpiji akan berbentuk gas. Volume elpiji dalam bentuk cair lebih kecil dibandingkan dalam bentuk gas untuk berat yang sama. Karena itu elpiji dipasarkan dalam bentuk cair dalam tabung-tabung logam bertekanan. Untuk memungkinkan terjadinya ekspansi panas dari cairan yang dikandungnya, tabung elpiji tidak diisi secara penuh, hanya sekitar 80-85% dari kapasitasnya. Rasio antara volume gas bila menguap dengan gas dalam keadaan cair bervariasi tergantung komposisi, tekanan dan temperatur, tetapi biasaya sekitar 250:1.
Tekanan di mana elpiji berbentuk cair, dinamakan tekanan uap-nya, juga bervariasi tergantung komposisi dan temperatur; sebagai contoh, dibutuhkan tekanan sekitar 220 kPa (2.2 bar) bagi butana murni pada 20 °C (68 °F) agar mencair, dan sekitar 2.2 MPa (22 bar) bagi propana murni pada 55°C (131 °F).
Menurut spesifikasinya, elpiji dibagi menjadi tiga jenis yaitu elpiji campuran, elpiji propana dan elpiji butana. Spesifikasi masing-masing elpiji tercantum dalam keputusan Direktur Jendral Minyak dan Gas Bumi Nomor: 25K/36/DDJM/1990. Elpiji yang dipasarkan Pertamina adalah elpiji campuran.
Sifat elpiji
Sifat elpiji adalah sebagai berikut:
- Cairan dan gasnya sangat mudah terbakar
- Gas tidak beracun, tidak berwarna dan biasanya berbau menyengat
- Gas dikirimkan sebagai cairan yang bertekanan di dalam tangki atau silinder.
- Cairan dapat menguap jika dilepas dan menyebar dengan cepat.
- Gas ini lebih berat dibanding udara sehingga akan banyak menempati daerah yang rendah.
Minyak bumi selain sebagai bahan bakar juga sebagai bahan industri kimia yang penting dan bermanfaat dalam kehidupan sehari-hari. Bahan-bahan atau produk yang terbuat dari bahan dasarnya minyak dan gas bumi disebut petrokimia. Bahan-bahan petrokimia dapat digolongkan: plastik, serat sintetik, karet sintetik, pestisida, detergen, pelarut, pupuk, berbagai jenis obat dan vitamin.
2.5.3.1 Bahan Dasar Petrokimia
Proses petrokimia umumnya melalui tiga tahapan, yaitu:
- Mengubah minyak dan gas bumi menjadi bahan dasar petrokimia
- Mengubah bahan dasar petrokimia menjadi produk antara, dan
- Mengubah produk antara menjadi produk akhir yang dapat dimanfaatkan.
- Olefin (alkena-alkena)
CH2 = CH2 CH2 = CH – CH3
Etilena propilena
CH3 – CH = CH – CH3 CH2 = CH – CH = CH2
Butilena butadiena
2. Aromatika (benzena dan turunannya)
Aromatika yang terpenting adalah benzena (C6H6), totuena (C6H5CH3) dan xilena (C6H4 (CH3)2
3. Gas Sintesis
Gas sintetis disebut juga syn-gas yang merupakan campuran karbon monoksida (CO) dan hidrogen (H2). Syn-gas dibuat dari reaksi gas bumi atau LPG melalui proses yang disebut stean reforming atau oksidasi parsial.
Reaksi stean reforming : CH4(g) + H2O → CO(g) + 3H2(g)
Reaksi oksidasi parsial : 2CH4(g) + O2 → 2CO(g) + 4H2(g)
2.5.3.2 Petrokimia dari OlefinBerikut ini beberapa petrokimia dari olefin dengan bahan dasar etilena:
- Polietilena
2. PVC
PVC adalah polivinilkiorida yang merupakan plastik untuk pembuat pipa (pralon).
3. Etanol
Etanol adalah bahan yang sehari-hari kita kenal sebagai alkohol yang digunakan untuk bahan bakar atau bahan antar produk lain.
Alkohol dibuat dari etilena:
CH2 = CH2 + H2O → CH3 – CH2OH
4. Etilen glikol atau GlikolGlikol digunakan sebagai bahan anti beku dalam radiator mobil di daerah beriklim dingin.
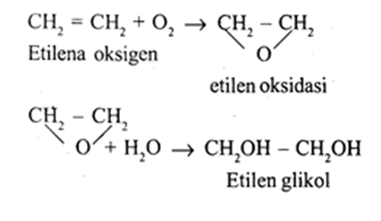
2.5.3.3 Petrokimia dari Aromatik
Bahan dasar aromatik yang terpenting adalah benzena, toluena, dan xilena (BTX). Bahan dasar benzena umumnya diubah menjadi stirena, kumena dan sikloheksana
- Stirena digunakan untuk membuat karet sinetik
- Kumena digunakan untuk membuat fenol, selanjutnya fenol untuk membuat perekat
- Sikloheksana digunakan terutama untuk membuat nylon
- Benzena digunakan sebagai bahan dasar untuk membuat detergen. Bahan dasar untuk toluena dan xilena untuk membuat bahan peledak (TNT), asam tereftalat (bahan pembuat serat).
Gas sinetik merupakan campuran dari karbon monoksida dan hidrogen. Beberapa contoh petrokimia dari syn-gas sebagai berikut:
- Amonia (NH3)
N2(g) + 3H2(g) → 2NH3(g)
Gas nitrogen dari udara dan gas hidrogennya dari syn-gas. Amonia digunakan untuk membuat pupuk [CO(NH2)2] urea, [(NH4)2SO4]; pupuk ZA dan (NH4NO3); amonium nitrat.- Urea [CO(NH2)2]
CO2(g) + 2NH3(g) → NH2COH4(S)
NH2CONH4(S) → CO(NH2)2(S) + H2O(g)
- Metanol (CH3OH)
CO(g) + 2H3(g) → CH3OH(g)
Sebagian besar metanol diubah menjadi formal-dehida dan sebagian digunakan untuk membuat serat dan campuran bahan bakar.- Formal dehida (HCHO)
CH3OH(g) → HCHO(g) + H2(g)
Formal dehida dalam air dikenal dengan formalin yang digunakan mengawetkan preparat biologi.2.5.4 Naptha atau Petroleum eter
biasa digunakan sebagai pelarut dalam industri.
2.5.5 Kerosin (minyak tanah)
biasa digunakan sebagai bahan bakar untuk keperluan rumah tangga. Selain itu kerosin juga digunakan sebagai bahan baku pembuatan bensin melalui proses cracking.
2.5.6 Minyak tanah (bahasa Inggris: kerosene atau paraffin)
adalah cairan hidrokarbon yang tak berwarna dan mudah terbakar. Dia diperoleh dengan cara distilasi fraksional dari petroleum pada 150°C and 275°C (rantai karbon dari C12 sampai C15). Pada suatu waktu dia banyak digunakan dalam lampu minyak tanah tetapi sekarang utamanya digunakan sebagai bahan bakar mesin jet (lebih teknikal Avtur, Jet-A, Jet-B, JP-4 atau JP-8). Sebuah bentuk dari kerosene dikenal sebagai RP-1dibakar dengan oksigen cair sebagai bahan bakar roket. Nama kerosene diturunkan dari bahasa Yunani keros.
Biasanya, kerosene didistilasi langsung dari minyak mentah membutuhkan perawatan khusus, dalam sebuah unit Merox atau, hidrotreater untuk mengurangi kadar belerangnya dan pengaratannya. Kerosene dapat juga diproduksi oleh hidrocracker, yang digunakan untuk mengupgrade bagian dari minyak mentah yang akan bagus untuk bahan bakar minyak.
Penggunaanya sebagai bahan bakar untuk memasak terbatas di negara berkembang, di mana dia kurang disuling dan mengandung ketidakmurnian dan bahkan “debris”.
Bahan bakar mesin jet adalah kerosene yang mencapai spesifikasi yang diperketat, terutama titik asap dan titik beku.
Kerosene juga bisa di gunakan untuk membasmi serangga seperti semut dan mengusir kecoa. Kadang di gunakan juga sebagai campuran dalam cairan pembasmi serangga.
2.5.7 Minyak solar atau minyak diesel,
biasa digunakan sebagai bahan bakar untuk mesin diesel pada kendaraan bermotor seperti bus, truk, kereta api dan traktor. Selain itu, minyak solar juga digunakan sebagai bahan baku pembuatan bensin melalui proses cracking.
2.5.8 Minyak pelumas
biasa digunakan untuk lubrikasi mesin-mesin.
2.5.9 Residu minyak bumi yang terdiri dari :
- Parafin , digunakan dalam proses pembuatan obat-obatan, kosmetika, tutup botol, industri tenun menenun, korek api, lilin batik, dan masih banyak lagi.
- Aspal , digunakan sebagai pengeras jalan raya
- 1. Sumber Bahan Pencemaran
- Pembakaran Tidak Sempurna
- Menghasilkan asap yang mengandung gas karbon monoksida (CO), partikel karbon (jelaga), dan sisa bahan bakar (hidroksida).
- Pengotor dalam Bahan Bakar
- Bahan bakar fosil mengandung sedikit belerang yang akan menghasilkan oksida belerang (SO2 atau SO3).
- Bahan Aditif (Tambahan) dalam Bahan Bakar
- Bensin yang ditambahi tetraethyllead (TEL) yang punya rumus molekul Pb(C2H5)4 akan menghasilkan partikel timah hitam berupa PbBr2.
a. Gas Karbon Dioksida (CO2)
Sebenarnya, gas karbon dioksida tidak berbahaya. Tetapi, gas karbon dioksida tergolong gas rumah kaca, sehingga peningkatan kadar gas karbon dioksida di udara dapat mengakibatkan peningkatan suhu permukaan bumi yang disebut pemanasan global.
b. Gas Karbon Monoksida (CO)
Gas karbon monoksida tidak berwarna dan berbau, sehingga kehadirannya tidak diketahui. Gas karbon monoksida bersifat racun, dapat menimbulkan rasa sakit pada mata, saluran pernapasan, dan paru-paru. Bila masuk ke dalam darah melalui pernapasan, gas karbon monoksida bereaksi dengan hemoglobin darah, membentuk karboksihemoglobin (COHb).
CO + Hb → COHb
Hemoglobin seharusnya bereaksi dengan oksigen menjadi oksihemoglobin
(O2Hb) dan dibawa ke sel-sel jaringan tubuh yang memerlukan.
O2 + Hb → O2Hb
Namun, afinitas gas karbon monoksida terhadap hemoglobin sekitar 300
kali lebih besar daripada oksigen. Bahkan hemoglobin yang telah mengikat
oksigen dapat diserang oleh gas karbon monoksida.
CO + O2Hb → COHb + O2
Jadi, gas karbon monoksida menghalangi fungsi vital hemoglobin untuk membawa oksigen bagi tubuh.Cara mencegah peningkatan gas karbon monoksida di udara adalah dengan mengurangi penggunaan kendaraan bermotor dan pemasangan pengubah katalitik pada knalpot.
c. Oksida Belerang (SO2 dan SO3)
Belerang dioksida yang terhisap pernapasan bereaksi dengan air di dalam saluran pernapasan, membentuk asam sulfit yang dapat merusak jaringan dan menimbulkan rasa sakit. Bila SO3 terhisap, yang terbentuk adalah asam sulfat (lebih berbahaya). Oksida belerang dapat larut dalam air hujan dan menyebabkan terjadi hujan asam.
d. Oksida Nitrogen (NO dan NO2)
Campuran NO dan NO2 sebagai pencemar udara biasa ditandai dengan lambang NOx. Ambang batas NOx di udara adalah 0,05 ppm. NOx di udara tidak beracun (secara langsung) pada manusia, tetapi NOx ini bereaksi dengan bahan-bahan pencemar lain dan menimbulkan fenomena asbut (asap-kabut). Asbut menyebabkan berkurangnya daya pandang, iritasi pada mata dan saluran pernapasan, menjadikan tanaman layu, dan menurunkan kualitas materi.
e. Partikel Timah Hitam
Senyawa timbel dari udara dapat mengendap pada tanaman sehingga bahan makanan terkontaminasi. Keracunan timbel yang ringan dapat menyebabkan gejala keracunan timbel, seperti sakit kepala, mudah teriritasi, mudah lelah, dan depresi. Keracunan yang lebih hebat menyebabkan kerusakan otak, ginjal, dan hati.
3. Pengubah Katalitik
Salah satu cara untuk mengurangi bahan pencemar yang berasal dari asap kendaraan bermotor adalah memasang pengubah katalitik pada knalpot kendaraan. Pengubah katalitik berupa silinder dari baja tahan karat yang berisi suatu struktur berbentuk sarang lebah yang dilapisi katalis (biasanya platina). Pada separuh bagian pertama dari pengubah katalitik, karbon monoksida bereaksi dengan nitrogen monoksida membentuk karbon dioksida dan gasnitrogen.
katalis
2CO(g) + 2NO(g) → 2CO2(g) + N2(g)
Gas-gas racun gas tak beracun Pada bagian berikutnya, hidrokarbon dan
karbon monoksida (jika masih ada) dioksidasi membentuk karbon dioksida
dan uap air. Pengubah katalitik hanya dapat berfungsi jika kendaraan
menggunakan bensin tanpa timbel.- 4. Efek Rumah Kaca
Efek rumah kaca berfungsi sebagai selimut yang menjaga suhu permukaan bumi rata-rata 15˚C. Tanpa karbon dioksida dan uap air di atmosfer, suhu rata-rata permukaan bumi diperkirakan sekitar –25˚C. Jadi, jelaslah bahwa efek rumah kaca sangat penting dalam menentukan kehidupan di bumi. Akan tetapi, peningkatan kadar dari gas-gas rumah kaca dapat menyebabkan suhu permukaan bumi menjadi terlalu tinggi sehingga dapat mneyebabkan berbagai macam kerugian.
5. Hujan Asam
Air hujan biasanya sedikit bersifat asam (pH sekitar 5,7). Hal itu terjadi karena air hujan tersebut melarutkan gas karbon dioksida yang terdapat dalam udara, membentuk asam karbonat.
CO2(g) + H2O(l) → H2CO3(aq)
Asam Karbonat
Air hujan dengan pH kurang dari 5,7 disebut hujan asam.
a. Penyebab Hujan Asam
SO2(g) + H2O(l) → H2SO3(aq)
asam sulfit
SO3(g) + H2O(l) → H2SO4(aq)
asam sulfat
2NO2(g) + H2O(l) → HNO2(aq) + HNO3(aq)
asam nitrit asam nitrat
b. Masalah yang Ditimbulkan Hujan Asam
- Kerusakan Hutan
- Kematian Biota Air
- Kerusakan Bangunan
Bahan bangunan sedikit-banyak mengandung kalsuim karbonat. Kalsium karbonat larut dalam asam, maka dapat bereaksi.
CaCO3(s) + 2HNO3(aq) → Ca(NO3)2(aq) + H2O(l) + CO2(g)
c. Cara Menangani Hujan Asam
- Menetralkan asam
- Mengurangi emisi SO2
- Mengurangi emisi oksida nitrogen
BAB III
P E N U T U P
3.1. KesimpulanProses pembentukan minyak bumi yaitu berasal dari reaksi kalsium karbida, CaC2 (dari reaksi antara batuan karbonat dan logam alkali) dan air yang menghasilkan asetilena yang dapat berubah menjadi minyak bumi pada temperatur dan tekanan tinggi.
Produk hasil pengolahan minyak bumi antara lain : Bahan bakar, napta, gasoline, kerosin, minyak solar, minyak pelumas dan residu. Minyak bumi selain bahan bakar juga sebagai bahan industri kimia yang penting dan bermanfaat dalam kehidupan sehari-hari yang disebut petrokimia.
Dampak yang ditimbulkan dari pembakaran bahan bakar yang tidak sempurna Pembakaran bahan bakar yang tidak sempurna, akan menghasilkan senyawa-senyawa kimia yang dalam bentuk gas dapat mencemari udara dan kadang-kadang mengasilkan partikel-pertikel yang menimbulkan asap cukup tebal, sehingga dapat menyebabkan terjadinya pencemaran udara.
Pencemaran lain adalah gas karbon monoksida, Co, gas ini berbahaya pada tubuh manusia karena lebih mudah terikat pada hemoglobin darah, sehingga kemampuan darah mengikat oksigen menjadi menurun.
3.2 Saran
Oleh karena minyak bumi itu
proses pembentukannya lama, maka kita harus berhemat dalam
pemanfaatannya, agar minyak bumi itu tidak cepat habis. Dan penggunaan
bensin / bahan bakar haruslah yang tidak berdampak negatif terhadap
lingkungan alam sekitarnya
DAFTAR PUSTAKA
Chang, Raymond.2002.Chemistry.edisi ke-7 New York : McGraw Hill
Departemen pendidikan dan Kebudayaan. 1995. Glosarium Kimia. Jakarta Balai Pusaka
Ika Ratna Sari, S.Pd. 2006. Metode Belajar Efektif Kimia : Jawa Tengah. CV Media Karya Putra.
Tidak ada komentar:
Posting Komentar